(ברצוני להודות לשחר מ-"תודעה כוזבת" על הערותיו מאירות העיניים, אשר סייעו בכתיבת הפוסט)
עד כה, כשדיברנו על המטרה שלנו כתיאור ההתנהגות של המערכת, דרשנו שנוכל להגיד איפה כל גוף בה נמצא בכל רגע נתון. כלומר שעבור כל גוף נוכל לכתוב את המיקום שלו כפונקציה של הזמן. אם אנחנו חושבים על המערכת כמכילה כוכב לכת המקיף את השמש, או על כמה כדורים שמתנגשים זה בזה, הרי שהמצב פשוט יחסית. אבל מה קורה אם מספר הגופים הוא עצום? מה קורה אם אנחנו מדברים לא על גוף אחד או שניים אלא על גופים — שזהו פחות ממספר האטומים שיש בגרם אחד של מימן? רק כדי שאפשר יהיה לקבל פרורפוציה על גודלו של המספר הזה, מאז שנוצרה מערכת השמש חלפו כ-
שניות — אחד חלקי מיליון ממספר הגופים במערכת שלנו. במערכת כזו, ברור שאין טעם לדבר על מיקומו של כל גוף בכל זמן שהוא. גם אם היינו יכולים לכתוב את אוסף הפונקציות האלה לא היינו ממש יודעים מה לעשות איתו. בדיוק כדי לטפל במערכות כאלו נולדה המכניקה הסטטיסטית. במכניקה סטטיסטית אנו זונחים את הרעיון לפיו התיאור הרצוי של המערכת הוא תיאור המיקום של כל אחד מהגופים, ועוברים לעסוק בתכונות של המערכת כולה. אלו הם גדלים סטטיסטיים במובן שכל אחד מהחלקיקים הרבים שמרכיבים את המערכת תורם להם.
מכיוון שעלינו לוותר על שאלות הנוגעות לגופים ספציפיים בתוך המערכת, ולעבור לגדלים סטטיסטיים על המערכת כולה, אנחנו צריכים לדעת כיצד לבחור את התיאור הנכון של המערכת. נביט, בתור דוגמה למערכת פשוטה, על אוסף של כדורי ביליארד המתנגשים זה בזה על גבי שולחן בעל צורה כללית כלשהי. נניח שהכדורים אינם מאבדים אנרגיה — כלומר שאין חיכוך בינם לבין השולחן ושאנרגיה לא אובדת בהתנגשויות ביניהם. אם כך, ברור לנו שהאנרגיה הכוללת של המערכת נשמרת ולא משתנה בזמן. אבל ישנן מערכות רבות החולקות את אותה האנרגיה: אנחנו יכולים לחשוב על מצב בו כל הכדורים נמצאים במנוחה ורק כדור אחד נע במהירות עצומה, או על מצב בו לכל הכדורים פחות או יותר מהירות זהה שהיא אך שבריר ממהירותו של הכדור במצב הראשון שתואר. ובין שני מצבי הקיצון הללו ישנו רצף עצום ורב של מצבים שונים המייצגים התפלגות שונה של המהירויות. מבחינה אינטואיטיבית ברור לנו שאם נתחיל עם מערכת בה כל הכדורים נמצאים במנוחה ורק לכדור אחד מהירות גבוהה מאוד, הרי שכעבור זמן מה הוא יתנגש בכדורים אחרים, יעביר אליהם ממהירותו וכך אט-אט המערכת תתקרב יותר למצב בו כל הכדורים נעים והאנרגיה מתחלקת באופן שוויוני יותר בין כולם. האינטואיציה הזו, כמובן, אינה נכונה תמיד, ובהמשך אני ארחיב מעט על מערכות בהן התהליך הזה אינו מתרחש, אבל עבור מערכת כללית התיאור הזה יחסית מדויק. כיצד אנו יכולים לתאר את האינטואיציה הזו בצורה מתמטית?
נביט על אוסף כל המצבים שמאופיינים באנרגיה . עם חלוף הזמן מערכת בעלת אנרגיה
"מטיילת" בין המצבים השונים באוסף. כלומר אם בזמן כלשהו המערכת היתה במצב עם התפלגות מהירויות מסוימת, הרי שכעבור זמן מה, ובעקבות התנגשויות בין הכדורים, התפלגות המהירויות תשתנה. כעת נניח הנחה — שהיא כלל אינה טריביאלית — ולפיה אנו לא יכולים להעדיף מצב אחד באוסף על פני רעהו. כלומר אם יש לנו
מצבים בעלי אנרגיה זהה, הרי שהסיכוי שהמערכת תהיה באחד מהם ברגע נתון הוא
. אם אנחנו רוצים להסתכל על גודל המאפיין את המערכת לאורך פרק זמן מסוים אנחנו יכולים להחליף את המיצוע על פני זמן במיצוע על פני אוסף דמיוני של הרבה מערכות, שהמצב של כל אחת מהן נבחר באקראי מבין אוסף כל המצבים בהסתברות שווה. זוהי, פחות או יותר, ההנחה היחידה שאנחנו צריכים להניח כדי להסיק את מרבית המכניקה הסטטיסטית. הבה נראה לאן אנחנו יכולים להגיע בעזרתה.
נגדיר כעת גודל, שנקרא האנטרופיה של המערכת, שפשוט מתאר כמה מצבים יש בעלי אנרגיה מסוימת. מסיבות טכניות, האנטרופיה היא לא מספר המצבים אלא הלוגריתם של המספר הזה (מי שלא זוכר מהו לוגריתם מוזמן ללחוץ על הקישור להסבר פשוט)
כש-
כעת נחלק את המערכת הדמיונית שלנו לשני חלקים, אחד בעל אנרגיה והשני בעל אנרגיה
. מהו הסיכוי שנמצא את שני חלקי המערכת עם ערכי אנרגיה כאלו? כמובן שהסיכוי פרופורציונלי למספר המצבים הקיימים בהם האנרגיה מתחלקת כך. מספר המצבים מתקבל ממכפלת מספר המצבים בהם לתת המערכת הראשונה אנרגיה
ולתת המערכת השניה אנרגיה
המספר הזה הולך וגדל ככל שהסכום
הבה נמחיש ונסביר את ההתנהגות הזו באמצעות פישוט הדוגמה שלנו. במקום מהירויות שיכולות לקבל כל ערך שהוא, נניח שיש לנו מספר מסוים של מנות של אנרגיה שאנחנו יכולים לחלק בין הכדורים. כעת, נשאל כיצד מתפלג סך האנרגיה של קבוצת כדורים קטנה מסוימת. נתחיל במספרים קטנים יחסית: אם יש לנו מנות אנרגיה,
כדורים ואנחנו מעוניינים לדעת מהם הסיכויים שכדור אחד מסוים יקבל ערכי אנרגיה שונים? הכדור יכול להיות חסר אנרגיה, במקרה הזה אנחנו צריכים לחלק את
מנות האנרגיה בין שני הכדורים האחרים, ויש
דרכים שונות לעשות זאת (ספרו!). כעת לכדור יכולה להיות מנת אנרגיה בודדה, ואנחנו צריכים לחלק את שלוש מנות האנרגיה הנותרות בין שני הכדורים הנותרים, פעולה שיש
דרכים שונות לעשות. באופן דומה, שתי מנות אנרגיה לכדור יתקבלו משלוש דרכים שונות; יש שתי דרכים שונות בהן לכדור תהיינה שלוש מנות אנרגיה ולבסוף רק סיטואציה אחת בה לכדור כל
מנות האנרגיה — במקרה הזה שני הכדורים האחרים נותרים מיותמים. אם נסדר את התוצאות בטבלה, היא תראה כך
כאשר העמודה השלישית מתארת את החלק היחסי של האנרגיה שיש לכדור שלנו מכלל האנרגיה במערכת, והעמודה הרביעית את הסיכוי של כל תרחיש, כאשר הסיכוי נורמל בצורה קצת יוצאת דופן — התרחיש הסביר ביותר קיבל את הערך
אבל זו מערכת קטנה מאוד, ומיותר להשתמש במכניקה סטטיסטית כדי לנתח אותה. מה יקרה כאשר נגדיל את המערכת? נניח שיש לנו מנות של אנרגיה,
כדורים ואנחנו מעוניינים בהתפלגות האנרגיה היחסית של
כדורים (שימו לב שמדובר ביחסים זהים לאלו בתסריט שחושב לעיל). חישבתי את ההתפלגות הזו עבור ערכי
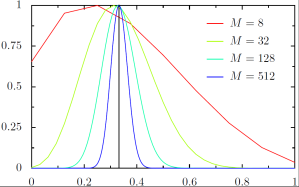
הולכים וגדלים והתוצאות מוצגות בגרף הבא. ציר
הוא שיעור האנרגיה היחסית של קבוצת הכדורים, וציר
הוא הסיכוי המנורמל שזו תהיה האנרגיה, הקו האנכי השחור מציין המצב בו שליש מהאנרגיה הכוללת במערכת נמצאת באותם
כדורים
כפי שניתן להתרשם, ככל שהמערכת גדלה כך הסיכויים הולכים ומתמקדים סביב הערך של שליש, וכבר במערכת קטנה יחסית של
בתור דוגמה נוספת, יום-יומית ואולי אינטואיטיבית יותר, אפשר לחשוב על כוס קפה שהונחה בחדר. המצב הראשוני הוא בו הרבה אנרגיה מרוכזת בכוס, אך עם חלוף הזמן האנרגיה מתחלקת פחות או יותר שווה בשווה בין חלקי החדר השונים. למרות שיכול להיות מצב בו דווקא ההפך יקרה — כלומר שהאנרגיה מחלקי החדר תתרכז לכוס (והקפה יתחמם מחדש) — הרי שזה טרם קרה לי, ואני מנחש שגם הקוראים טרם חוו חוויה כזו. כשאנחנו מסתכלים על הגרף למעלה, אנחנו יכולים להבין את הסיבה לכך.
בפוסטים הבאים אני מקווה להמשיך ולפתח את הנושא של מכניקה סטטיסטית, ובין היתר להגדיר את אותו גודל חמקמק שנקרא "טמפרטורה". אבל לפני שנמשיך ראוי להזכיר את המצבים המעניינים בהם הכלים הסטנדרטים של המכניקה הסטטיסטית מכשילים אותנו. נניח ששולחן הביליארד שלנו אינו בעל צורה אקראית, אלא מלבן. ונניח שאנחנו מרכזים יפה את כל הכדורים מלבד אחד בפינה אחת שלו, ולכדור הנותר אנו נותנים מהירות כך שהוא פשוט ינוע בין שני קירות מנוגדים של השולחן, בלי להתקרב לאוסף הכדורים שנח בפינה. ברור שבמצב כזה המערכת לא "מטיילת" בכל מרחב המצבים שווי האנרגיה, ושגם כעבור זמן אינסופי נוותר בדיוק באותו המצב. קיימים שני סוגים של מערכות פיזיקליות מעניינות בעלות תכונה זו — הן נמצאות רק בחלק ממרחב המצבים. סוג אחד נקרא מערכות "לא-ארגודיות" והסוג השני מערכות "אינטגרביליות", וראוי להקדיש לכל אחת מהן פוסט משל עצמן. אבל עוד חזון למועד.
תגים: אנטרופיה, אנרגיה, מכניקה סטטיסטית, פיסיקה, תרמודינמיקה

מאי 21, 2010 ב- 10:29 am
שאלה ראשונה, ואולי יהיו עוד בהמשך – בהתחלה, כשאתה מחלק את המערכת לשתי תת-מערכות, אתה מניח גם ששתי תת-המערכות זהות למערכת המקורית בכל מלבד האנרגיה שלהם, וששתי תת-המערכות הן בלתי תלויות מבחינת מצביהן?
מאי 21, 2010 ב- 11:59 am
מוכרת לי היטב ההיסחפות אחרי דיסציפלינה בעלת עצמה. במקרה שלי – גאומטריה פרקטאלית, אותה ניסיתי להפעיל על מערכות המאופיינות בקומפנסאציה של אנרגיה-אנטרופיה. כתבתי אפילו שני מאמרים קטנים בנושא, לפני הרבה שנים. בסופו של דבר, ההתפעמות מפרקטאלים די נרגעה, לאחר שהתחלתי להגיע למסקנה שיש כאן יותר מערכת דיסקריפטיבית-תיאורית, של חזקות לא רציונליות (או לא שלמות לגבי מימדים) וההבנה הפיזיקלית שלי לא כל כך מעמיקה כתוצאה מכך. לא התמחתי ברנורמליזציה ואני מניח שזה תחום בעל פוטציאל העמקה מעבר לפרקטאלים. בכל אופן, כתיבתך (קראתי בינתיים את פרק 5) היא מעניינת וכלל לא טריוויאלית, ואני מקווה שתמשיך כך.
בברכה
ברוך
מאי 21, 2010 ב- 10:35 pm
גדי – זו אבחנה מצוינת!
אכן, כדי שהכללים שנתתי כאן יהיו תקפים, אנחנו צריכים להניח שהאנרגיה של שתי תת המערכות (ולמעשה – של כל מספר כלשהו של תת מערכות בגודל תרמודינמי) אינן תלויות אחת בשניה. רק ההנחה הזו הופכת את האנרגיה ואת האנטרופיה של המערכת למה שמכונה גודל אקסטנסיבי – כלומר גודל שתלוי פרופורציונלית בגודל המערכת.
כדי שהתנאי הזה יתקיים צריך שכל האינטראקציות במערכת תהיינה בעלות טווח סופי. למזלנו, בעולם האמיתי במערכות כאלו תמיד האינטראקציות הן בעלות טווח סופי (למיטב ידיעתי). אני מכיר מקרים בהם בונים מודלים עם אינטראקציות בעלות טווח אינסופי, אבל זה למטרות אילוסטרציה ופישוט. במקרים האלה משתמשים בטריק מסוים כדי לשמור על האנרגיה והאנטרופיה אקסטנסיבים וכך משחזרים את יכולת הטיפול במערכת.
שווה אולי להבין, ב-"נפנופי ידיים", למה אם האינטראקציות סופיות אז אין קורלציה בין תתי מערכות, בגבול של גודל מערכת אינסופי: עבור אינטראקציה סופית הקורלציה בין שתי תת מערכות תלויה בשטח הפנים של תת המערכת, בעוד האנרגיה תלויה בנפח תת המערכת. היחס בין הגדלים הללו מתנהג כמו גודל המערכת, וכאשר תת המערכת גדולה מספיק (וזו *תמיד* ההנחה שלנו) אז הקורלציה דועכת לאפס.
מאי 22, 2010 ב- 12:08 am
ברוך – תודה רבה.
עלי להודות שבתחום של כאוס ודינמיקה לא לינארית ההבנה שלי מועטה מאוד, ומתמצה בניסוי אחד בתואר הראשון (שאת רובו אני לא מבין עד היום) ובכמה שיעורים על מערכת כאוטית אחת באופטיקה קוונטית.
המחשבה האינטואיטיבית הראשונית שלי היא שרנורמליזציה תהיה דווקא כלי חלש לניתוח מערכות כאוטיות, שכן היא מסתמכת על תופעות של סדר ארוך-טווח. אבל לאור ההבנה המוגבלת שלי בהחלט ייתכן שאני טועה.
יולי 16, 2010 ב- 12:34 pm
לצערי, אין לי את הכלים להבין את הפוסט הזה. פיזיקה ומתמטיקה מפחידות אותי. אבל יש לי מה לומר על החוק השני של התרמודינמיקה:
כשהייתי בתיכון נתקלתי בחוק השני של התרמודינמיקה במסגרת לימודי הכימיה. ככל הנראה, זה היה אחד מהדברים הפרקטיים היחידים שיצא לי ללמוד. הייתי ילד מבולגן בצורה נוראית, ופעם בכמה שבועות אבא שלי היה נכנס אלי לחדר זועם כולו ומנסה להכריח אותי להשליט סדר בבלאגן. הפרצוף שהוא קיבל כשאמרתי לו באחת מהפעמים האלה "אבל אבא, אין טעם. אתה הרי מכיר את החוק השני של התרמודינמיקה. לא משנה מה אעשה, אי הסדר רק יעלה" היה בהחלט שווה את התפרצות הזעם שהוא התפרץ עלי (התפרצות שבה הוא הוכיח את הנקודה שלי: הוא העלה את אי הסדר באמצעות גריפת כל מה שהיה על השולחן שלי אל הרצפה).
אוגוסט 3, 2010 ב- 4:36 pm
יש כמה נקודות עדינות עם אנטרופיה. דוגמה ידועה היא פרדוקס גיבס:
אם מערבבים שני גזים שונים, האנטרופיה עולה, אבל אם מערבבים את אותו הגז, האנטרופיה לא משתנה (כאילו דא!). אבל השאלה אם מדובר בשני גזים שונים או זהים היא בעצם שאלה "סוביקטיבית" – עד כמה אנחנו מסוגלים להבדיל בין שני חומרים באופן מקרוסקופי. יש דיון מאוד יפה ופוקח עיניים בג'יינס[1] שמראה שאנטרופיה היא לא באמת "קשיחה" ואוביקטיבית.
אגב, רק עכשיו נתקלתי בבלוג שלך, יישר כוח, תמיד רציתי לכתוב משהו על "רנורמליזציה להולכי רגל", אני מקווה שיצליח לך.
[1] http://bayes.wustl.edu/etj/articles/gibbs.paradox.pdf
אוגוסט 3, 2010 ב- 5:40 pm
מצטער על התגובה המאוחרת שלי. תקופה קצת קדחתנית. זו גם הסיבה שעדיין לא כתבתי את הפוסט הבא, למרות שהוא יחסית מתבקש.
רועי – אתה כמובן צודק. יותר מכך – השקעה בסידור החדר מעלה את אי הסדר בך (חום הגוף שלך עולה). למעשה, כשהורה דורש מילדו לסדר את החדר הוא שם את האנטרופיה של החדר בעדיפות גבוהה יותר מהאנטרופיה של הילד עצמו. אכזריות לשמה.
ראובן – תודה על התגובה ועל ההפניה (ועל איחולי ההצלחה – אני בודאי אזדקק להם). אכן ההגדרה של האנטרופיה תלויה גם בגדלים המקרוסקופיים הרלבנטיים, והשאלה מהם עשויה להיות סובייקטיבית.
אוקטובר 22, 2011 ב- 8:52 pm
ראובן ויובל – השאלה אם חלקיק הוא מובחן או לא מובחן איננה סובייקטיבית כלל. מעקרון האיסור של פאולי ברור כי יש הבדל פיסיקלי משמעותי בין חלקיקים מובחנים לשאינם.